·综述·
UGT1A1基因多态性与伊立替康化疗毒性关系的研究进展
陈文兴,徐 亮,綦晓龙
(四川医科大学附属第一医院 胃肠外科,四川 泸州 646000)
摘 要: 消化道肿瘤是严重威胁人类健康的常见肿瘤,目前消化道肿瘤治疗方案多为根治性手术切除后辅以化学治疗。既往消化道肿瘤化疗方案以5-氟尿嘧啶(5-Fu)或其衍生物为主。而近年来研制出如伊立替康、奥沙利铂等细胞毒类药物,使消化道肿瘤患者化疗效果有了很大提高。含伊立替康的化疗方案,治疗效果明显。但同时可能发生严重毒性反应,如严重延迟性腹泻、中性粒细胞减少等。以往对伊立替康所致严重毒性反应分子水平研究较少。近来大量分子水平研究表明伊立替康化疗严重毒性反应与其代谢过程的某些酶基因多态性相关。
关键词: 消化系统肿瘤;伊立替康;DNA拓扑异构酶类, Ⅰ型;基因多态性;药物毒性
伊立替康为半合成水溶性喜树碱,为DNA拓扑异构酶Ⅰ(Topoisomerase TOPO Ⅰ)抑制剂,作用于细胞周期S期,通过与DNA形成裂解复合物导致DNA链断裂,导致肿瘤细胞死亡而发挥抗肿瘤活性。伊立替康抗肿瘤普广,现已用于胃癌、结直肠癌、肺癌等实体肿瘤的治疗[1]。尤其是在消化道肿瘤的治疗方面,伊立替康联合氟尿嘧啶治疗结直肠癌可以延长患者生存期[2]。但是,伊立替康的应用受其剂量限制性毒性的影响,尤其是严重的延迟性腹泻和骨髓抑制。因此各国学者就伊立替康代谢机制、毒性相关因素进行了大量研究,结果显示参与伊立替康代谢过程的某些酶基因多态性可能影响伊立替康的毒性,其中研究最多的是尿苷二磷酸葡苷酸转移酶1A1(Uridine Diphosphate Glucuronosyl transferase 1A1,UGTIAI)。我们就伊立替康毒性与UGTIAI基因多态性关系研究进展综述如下。
1 伊立替康
1.1 伊立替康结构及体内代谢过程 伊立替康为可溶性喜树碱类似物,主干结构类似喜树碱的五环化学结构,在五环结构的C7和C10分别加入一个乙基和双六氢吡啶酸链,从而使其具有水溶性。在水溶液中伊立替康有内酯和羧基两种形式,且呈动态平衡,平衡常数受PH值影响。在酸性环境下,偏向内酯形式。一般认为内酯形式是其活性形式,而羧基形式对拓扑异构酶(TOPO)没有抑制作用。
伊立替康主要在肝脏代谢,在肝内经高亲和性羧酸酯酶(Carboxylesterase CES)水解脱去C10基团,形成活性代谢产物7-乙基-10-羟基喜树碱(7-ethyl-10-hydroxy camptothecin,SN-38),SN-38的细胞毒活性较伊立替康原药增强100~1 000倍。随后伊立替康及SN-38经血液循环到达肿瘤细胞,作用于拓扑异构酶而发挥抗肿瘤作用。剩余SN-38经血液循环到达肝脏,在肝内经UGTIAI介导醛酸化成无活性的SN-38葡糖甘酸(SN-38G)后经胆道系统排入肠道。在肠道内伊立替康及其代谢产物又可经细菌β-葡萄糖醛酸酶作用转化为SN-38,继而引起肠黏膜损伤和延迟性腹泻[3]。
1.2 伊立替康抗肿瘤机制及应用价值 拓扑异构酶通过催化DNA拓扑结构转变而影响细胞DNA的复制、转录等生命过程[4]。拓扑异构酶在肿瘤细胞中高水平表达,因此抑制DNA拓扑异构酶的活性就能抑制肿瘤细胞增殖,使肿瘤细胞凋亡。拓扑异构酶抑制剂进入细胞后通过氢键和分子间疏水键作用与TOPOⅠ-DNA复合物共价结合形成相对稳定的TOPO 1-药物-DNA复合物,导致DNA链的断裂,抑制DNA修复,促进细胞凋亡。伊立替康作为TOPO I抑制剂,它将TOPO I转变成对DNA有害的物质,即TOPO I的浓度越高,对药物就越敏感。研究表明大肠癌、宫颈癌、卵巢癌等肿瘤细胞内的TOPO I含量远高于正常组织,尤其在S期肿瘤细胞中活性大幅度提高。因此,TOPO I抑制剂可以选择性作用于增殖期肿瘤细胞,抑制DNA复制,发挥抗肿瘤活性。
1.3 伊立替康毒性反应 伊立替康毒性反应有延迟性腹泻,骨髓抑制,肝肾功能损害,急性乙酰胆碱能综合征等。特别是其剂量限制性毒性:延迟性腹泻和骨髓抑制。日本有3、4级延迟性腹泻和骨髓抑制至患者死亡的报道[5]。国内也有类似报道[6]。故我们需深入研究其毒性反应发生机制及处理措施,及时发现、干预,避免此类悲剧的再发生。
1.3.1 延迟性腹泻 延迟性腹泻指应用伊立替康24小时后出现的腹泻,为剂量限制性毒性。常发生在用药后第5天[7]。严重延迟性腹泻致化疗终止、进而影响其疗效,国外报道接受伊立替康治疗后因出现3~4级延迟性腹泻而导致化疗方案提前终止者约40%[8]。而国内许多学者研究显示,伊立替康致3~4级延迟性腹泻的发生率为5.9%~20.0%[9-10]。其机制可能是经胆道排入肠道的伊立替康及代谢产物在CES和β-葡萄糖苷酸酶的作用下转化为SN-38。而SN-38可以通过干扰DNA的TOPOⅠ而对肠黏膜产生损伤[11],肠道吸收功能障碍,干扰体内电解质平衡,导致延迟性腹泻的发生。
1.3.2 骨髓抑制 伊立替康及其代谢产物抑制DNA复制,杀伤肿瘤细胞的同时也导致正常细胞的损伤,从而引起骨髓抑制。伊立替康所致骨髓抑制高峰为用药后第8天。发生率高,主要表现为白细胞及中性粒细胞减少。然而伊立替康引起的骨髓抑制是可逆转、非蓄积的,故使用前后需监测血常规变化。国外一项Ⅱ期临床试验研究,采用联合伊立替康、5-氟尿嘧啶(5-Fu)、亚叶酸钙(CF)组成FOLFIRI方案治疗54例晚期结直肠癌患者,其中3~4级中性粒细胞减少的发生率为61%[12]。由此可见,伊立替康致骨髓抑制发生率高,尤需注意3~4 级中性粒细胞减少的发生,及时给予处理。
2 UGT1A1基因多态性
UGT1基因定位于2q37,至少有13个不同的启动子序列,其第1个外显子剪接成共有外显子2~5,形成具有特殊N末端和保守C末端结构域的不同亚型。UGT1A1为其一个亚型,是唯一与胆红素葡萄糖醛酸化生物途径相关的亚型。UGT1A1基因变异有插入、缺失、单核苷酸多态性等。UGT1A1基因变异可导致UGT1A1表达减少,从而引起药物及胆红素代谢障碍,致使药物毒性增加,导致Crigler-Najjar综合征或Gilbert综合征的发生[13]。
UGT1A1基因位点的改变多达50余种,其中UGT1A1*28和UGT1A1*6基因多态性与伊立替康化疗毒性反应和疗效关系尤受关注[14]。UGT1A1基因启动子区存在大量TA碱基重复序列,UGT1A1*1为6个TA重复序列,即(TA6/TA6或*1/*1);UGT1A1*28为7个TA重复序列,包括纯合型(TA7/TA7或*28/*28)和杂合型(TA6/TA7或*1/*28)。随着TA重复序列数目的增加,UGT1A1表达下降,使用伊立替康后其代谢产物SN-38转化为SN-38G减少,SN-38过度累积,引起严重的伊立替康相关毒性[15]。UGT1A1基因多态性情况,见表1。
表1 UGT1A1基因多态性
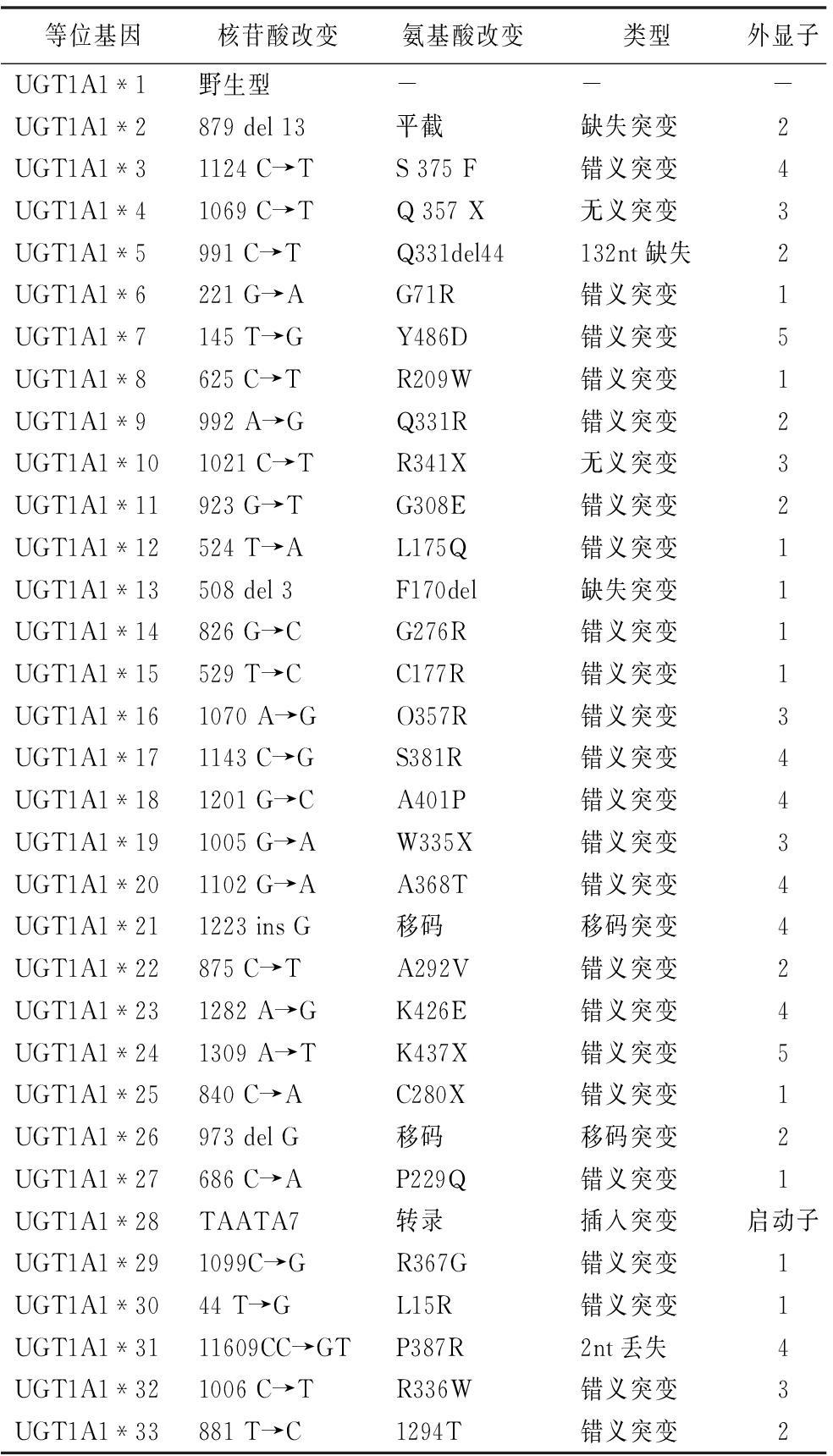
等位基因核苷酸改变氨基酸改变类型外显子UGT1A1*1野生型---UGT1A1*2879del13平截缺失突变2UGT1A1*31124C→TS375F错义突变4UGT1A1*41069C→TQ357X无义突变3UGT1A1*5991C→TQ331del44132nt缺失2UGT1A1*6221G→AG71R错义突变1UGT1A1*7145T→GY486D错义突变5UGT1A1*8625C→TR209W错义突变1UGT1A1*9992A→GQ331R错义突变2UGT1A1*101021C→TR341X无义突变3UGT1A1*11923G→TG308E错义突变2UGT1A1*12524T→AL175Q错义突变1UGT1A1*13508del3F170del缺失突变1UGT1A1*14826G→CG276R错义突变1UGT1A1*15529T→CC177R错义突变1UGT1A1*161070A→GO357R错义突变3UGT1A1*171143C→GS381R错义突变4UGT1A1*181201G→CA401P错义突变4UGT1A1*191005G→AW335X错义突变3UGT1A1*201102G→AA368T错义突变4UGT1A1*211223insG移码移码突变4UGT1A1*22875C→TA292V错义突变2UGT1A1*231282A→GK426E错义突变4UGT1A1*241309A→TK437X错义突变5UGT1A1*25840C→AC280X错义突变1UGT1A1*26973delG移码移码突变2UGT1A1*27686C→AP229Q错义突变1UGT1A1*28TAATA7转录插入突变启动子UGT1A1*291099C→GR367G错义突变1UGT1A1*3044T→GL15R错义突变1UGT1A1*3111609CC→GTP387R2nt丢失4UGT1A1*321006C→TR336W错义突变3UGT1A1*33881T→C1294T错义突变2
UGT1A1基因多态性在种族间分布存在差异性。UGT1A1*28/*28在非洲人和高加索人中的频率分别为12%~27%和5%~15%。而在亚洲人中仅为1.2%~5%[16]。一项汉族人UGT1A1基因分布频率研究发现UGT1A1*1/*1占79.7%,UGT1A1*1/*28占15.6%, UGT1A1*28/*28占4.7%[17]。N9741试验报道显示UGT1A1*28/*28在黑种人较白种人更多见(14%vs.9%)[18]。最新调查发现即使在亚洲,UGT1A1*28/*28的分布亦存在差异,其中在印度人约为8%,中国人约为4%[19]。由于其分布差异,导致各种族患者使用伊立替康后严重毒性反应发生率存在差异。
3 UGT1A1基因多态性与伊立替康毒性反应关系
伊立替康的活性产物SN-38作用于肿瘤细胞后经UGT1A1灭活,可见UGT1A1的浓度及活性将影响伊立替康的活性产物SN-38的浓度,进而影响其毒性反应。国内外多个实验表明遗传因素在伊立替康作用机制中起重要作用。UGT1A1基因启动子区TA序列重复次数尤为重要,如UGT1A1*28 可能引起UGT1A1 表达下降,减少SN-38向SN-38G的转化,使伊立替康引起严重延迟性腹泻及粒细胞减少。可见UGT1A1的遗传多态性及酶表达水平与伊立替康的细胞毒性反应发生均密切相关。
3.1 伊立替康毒性反应与UGT1A1*28基因多态性关系 UGT1A1*28是目前研究最多的UGT1A1基因位点,其多态性指TATA盒胸腺嘧啶-腺嘌呤重复序列。纯合基因型TA6/6为(6次TA重复)的两个UGT1A1*1个体;纯合突变基因型即TA7/7为两个UGT1A1*28等位基因(7次TA重复)的个体;杂合突变基因型TA6/7是指1个UGT1A1*1等位基因和1个UGT1A1*28等位基因的个体。
最早的一项研究发现与野生型患者相比,UGT1A1*1/*28突变杂合子患者使用伊立替康后粒细胞减少的风险达12.5%,而UGT1A1*28/*28纯合突变患者发生严重毒性反应的风险高达50%[20]。此后大量研究表明UGT1A1*28基因多态性增加伊立替康化疗所致严重粒细胞减少的风险[21-23]。鉴于此,2005年6月美国食品药品监督管理局(FDA)要求伊立替康制药公司修改其说明书,警告患者若为UGT1A1*28纯合突变,使用伊立替康后毒性反应风险增加,并呼吁减少用药起始剂量。一项纳入20个试验,1 760例患者的荟萃分析显示伊立替康所致严重延迟性腹泻风险:中等以上剂量时UGT1A1*28/*28组明显高于UGT1A1*1/*1组,UGT1A1*1/*28组也高于UGT1A1*1/*1组。而低剂量伊立替康(<125 mg/m2)中并未发现UGT1A1*28基因与严重延迟性腹泻相关[24]。而一个国际多中心临床试验纳入105例晚期结直肠癌白种人,发现UGT1A1*28与延迟性腹泻无关[25]。近来一项Ⅲ期随机临床研究证实UGT1A1*28/*28基因型增加患者发生中性粒细胞减少及延迟性腹泻的风险[22]。而另一项国外研究并未发现UGT1A1*28与伊立替康毒性反应相关[26]。一项来自台湾,纳入128例晚期结直肠癌患者的回顾性研究显示:UGT1A1*28与UGT1A1*1 相比,3~4度白细胞减少的发生率及严重延迟性腹泻的发生率、化疗前血清胆红素水平均显著增高[17]。季楚舒等[9]发现UGT1A1*28非野生型的基因多态性使患者发生Ⅲ度以上延迟性腹泻的风险增加。李虎等[27]研究同样发现UGT1A1基因多态性为伊立替康所致延迟性腹泻的独立影响因素,TA6/7和TA7/7基因型患者发生延迟性腹泻的风险高于TA6/6基因型。日本一项研究证实UGT1A1*28基因多态性与严重粒细胞减少相关[23],但也有研究发现UGT1A1*28基因多态性与严重粒细胞减少的风险无关[28]。由此可见UGT1A1*28基因多态性与严重延迟性腹泻及中性粒细胞减少的关系有待进一步研究。
3.2 伊立替康毒性反应与UGT1A1*6基因多态性关系 UGT1A1*6是亚洲人常见的UGT1A1基因变异体,且仅在亚洲人中发现,并已证实此变异体能使UGT酶活性减低[29]。UGT1A1*6为UGT1A1基因第一个外显子211位碱基的突变(211G>A),包括UGT1A1*6野生型G/G,UGT1A1*6杂合突变型G/A,UGT1A1*6纯合突变型A/A。因UGT1A1*28在亚洲人群分布率低,故UGT1A1*6已成为研究热点,并取得了一定进展。但是其对伊立替康毒性反应的预测作用尚不明确。一项对177例接受伊立替康单药或联合用药的日本患者进行的研究显示,具有UGT1A1*6(211G>A)单倍体患者SN-38G、SN-38 的药时曲线下面积(AUC)减少,发生严重粒细胞减少的风险增加[30]。Yamashita[31]和Satoh等[32]进行的研究同样得出类似结果。故美国FDA修改了伊立替康说明书,增加UGT1A1*28 和*6对伊立替康代谢和药物不良反应的内容。在我国一项对70例结直肠癌患者进行研究,结果显示UGT1A1*6基因型频率分布情况为A/A 3.7%,A/G 36.0%,G/G 60.3%。大肠癌患者与健康人群之间的基因型分布无差异。但UGT1A1*6基因多态性与伊立替康毒性反应无关系[33],因UGT1A1*28突变在亚洲人中发生率低,而UGT1A1*6可能与伊立替康毒性反应相关,故结合两者综合考虑它们与伊立替康严重毒性反应的关系已成为目前主要研究方向。随后我们需进行多中心、大样本、随机实验研究,确定它们与伊立替康严重毒性反应的关系。
目前在伊立替康毒性反应分子标志物研究方面尚有UGT1A1*27,UGT1A7,UGT1A9,MDR1,ABCG2等。各研究结果不一,结论不同,尚需进一步研究。
4 小结
伊立替康是治疗进展期消化道肿瘤的重要药物,因其不可预知严重毒性反应而使其应用受到限制。遗传差异对其毒性反应影响大,目前很多学者着手研究基本达成共识,UGT1A1*28突变型纯合子(TA7/7)的患者,使用伊立替康时发生严重延迟性腹泻及骨髓抑制风险高,需调整用药剂量或改变治疗方案。若发生严重延迟性腹泻,在患者第一次发生腹泻时立即予以易梦停治疗,避免病情加重;若发生严重白细胞或中性粒细胞减少,予以粒细胞刺激因子治疗。但伊立替康毒性反应影响因素众多,即使排除UGT1A1*28基因型,患者在使用伊立替康时仍可能发生严重毒性反应。且遗传因素中UGT1A1*27,UGT1A7,UGT1A9,MDR1,ABCG2,CES,CYP3A4等基因变异均可能影响伊立替康体内代谢过程,从而影响其毒性反应。但是目前各家研究结果不一致,得出不同结论,尚需进一步研究。
总之,药物的个体化治疗已在全世界范围内达到共识。如何根据患者年龄,分期,疗效与毒性的预测标志物确定化疗药物的种类及剂量?未来我们将依靠更多综合的基因检测结果为伊立替康的个体化治疗服务。进而使肿瘤患者的生存率以及生活质量提高。
参考文献:
[1] 杨立学,马韬,张俊,等.伊立替康化学治疗的不良反应与UGT1A1* 28基因多态性的关系[J].内科理论与实践,2009,4(4):300-304.
[2] Douillard JY,Cunningham D,Roth AD,et al.Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomized trial[J].Lancet,2000,355(9209):1041-1047.
[3] Toffoli G,Cecchin E,Corona G,et al.Pharmacogenetics of irinotecan[J].Curr Med Chem Anticancer Agents,2003,3(3):225-237.
[4] Champoux JJ.DNA topoisomerases;structure,function,and mechanism[J]. Annu Rev Biochem,2001,70: 369-413.
[5] Ogawara D,Fukuda M,Nakamura Y,et al.Life-threatening toxicity in a patient with UGT1A1*6 heterozygous polymorphism after irinotecan-based chemotherapy:a case report[J].Acta Med Nagasaki,2014,59: 63-65.
[6] 曹凯,司继刚,孙敏,等.伊立替康相关腹泻及粒细胞缺乏致死亡[J].中国药物应用与监测,2014,11(1):57-59.
[7] 江伟,陈振东.FOLFIRI方案治疗老年结直肠癌安全性临床观察[J].安徽医科大学学报,2010,45(2):237-240.
[8] Alimonti A,Gelibter A,Pavese I,et al.New approaches to prevent intestinal toxicity of irinotecan-based regimens[J].Cancer Treat Rev,2004,30(6):555-561.
[9] 季楚舒,何义富,胡冰,等.UGT1A1*28 基因多态性与晚期结直肠癌伊立替康化疗疗效及不良反应的关系[J].肿瘤,2010,30(10):870-874.
[10] 王晖,武晓楠,丁丽,等.伊立替康相关不良反应与UGT1A1基因多态性的关系[J].现代肿瘤医学,2013,21(1):161-163.
[11] Dranitsaris G,Shah A,Spirovski B,et al.Severe diarrhea in patients with advanced-stage colorectal cancer receiving FOLFOX or FOLFIRI chemotherapy:the development of a risk prediction tool[J].Clin Colorectal Cancer,2007,6(5):367-373.
[12] Duffour J,Gourgou S,Desseigne F,et al.Multicentre phase Ⅱ study using increasing doses of irinotecan combined with a simplified LV5FU2 regimen in metastatic colorectal cancer[J].Cancer Chemother Pharmacol,2007,60(3):383-389.
[13] 张新玉,田辉.遗传性非结合型高胆红素血症[J].肝脏,2005,10(1):51-52.
[14] Takahara N,Nakai Y,Isayama H,et al.Uridine diphosphate glucuronosyl transferase1 family polypeptide A1gene(UGT1A1) polymorphisms are associated with toxicity and efficacy in irinotecan monotherapy for refractory pancreatic cancer[J].Cancer Chemother Pharmacol,2013,71(1):85-92.
[15] Desai AA,Innocenti F,Ratain MJ.UGT pharmacogenomics:implications for cancer risk and cancer therapeutics[J].Pharmacogenetics,2003,13(8):517-523.
[16] Hirose K,Kozu C,Yamashita K,et al.Correlation between plasma concentration ratios of SN-38 glucuronide and SN-38 and neutropenia induction in patients with colorectal cancer and wild-type UGT1A1 gene[J].Oncol Lett,2012,3(3):694-698.
[17] Liu CY,Chen PM,Chiou TJ,et al.UGT1A1*28 polymorphism predicts irinotecan-induced severe toxicities without affecting treatment outcome and survival in patients with metastatic colorectal carcinoma[J].Cancer,2008,112(9):1932-1940.
[18] Sanoff HK,Sargent DJ,Green EM,et al.Racial differences in advanced colorectal cancer outcomes and pharmacogenetics:a subgroup analysis of a large randomized clinical trial[J].J Clin Oncol,2009,27(25):4109-4115.
[19] Teh LK,Hashim H,Zakaria ZA,et al.Polymorphisms of UGT1A1*6,UGT1A1*27 & UGT1A1*28 in three major ethnic groups from Malaysia[J].Indian J Med Res,2012,136(2):249-259.
[20] Innocenti F,Undevia SD,Iyer L,et al.Genetic variants in the UDP-glucuronosyl transferase 1A1 gene predict the risk of severe neutropenia of irinotecan[J].J Clin Oncol,2004,22(8):1382-1388.
[21] Wang Y,Shen L,Xu N,et al.UGT1A1 predicts outcome in colorectal cancer treated with irinotecan and fluorouracil[J].World J Gastroenterol,2012,18(45):6635-6644.
[22] Martinez-Balibrea E,Abad A,Martínez-Cardús A,et al.UGT1A1 and TYMS genetic variants predict toxicity and response of colorectal cancer patients treated with first-line irinotecan and fluorouracil combination therapy[J].Br J Cancer,2010,103(4):581-589.
[23] Okuyama Y,Hazama S,Nozawa H,et al.Prospective phase Ⅱ study of FOLFIRI for mCRC in Japan,including the analysis of UGT1A1*28/*6 polymorphisms[J].Jpn J Clin Oncol,2011,41(4):477-482.
[24] Hu ZY,Yu Q,Zhao YS,et al.Dose-dependent association between UGT1A1 *28 polymorphism and irinotecan-induced diarrhea:a meta-analysis[J].Eur J Cancer,2010,46(10):1856-1865.
[25] Schulz C,Heinemann V,Schalhorn A,et al.UGT1A1 gene polymorphism:impact on toxicity and efficacy of irinotecan-based regiments in metastatic colorectal cancer[J].World J Gastroenterol,2009,15(40):5058-5066.
[26] Braun MS,Richman SD,Thompson L,et al.Association of molecular markers with toxicity outcomes in a randomized trial of chemotherapy for advanced colorectal cancer:the FOCUS trial[J]. J Clin Oncol,2009,27(33):5519-5528.
[27] 李虎,黄鹤,刘继红.UT1A1基因启动子多态性与伊立替康化疗毒性作用的关系[J].中华妇产科杂志,2011,46(12):888-891.
[28] Sunakawa Y,Ichikawa W,Fujita K,et al.UGT1A1*1/*28 and *1/*6 genotypes have no effects on the efficacy and toxicity of FOLFIRI in Japanese patients with advanced colorectal cancer[J].Cancer Chemother Pharmacol,2011,68(2):279-284.
[29] Fujita K,Sasaki Y.Pharmacogenomics in drug-metabolizing enzymes catalyzing anticancer drugs for personalized cancer chemotherapy[J].Curr Drug Metab,2007,8(6):554-562.
[30] Minami H,Sai K,Saeki M,et al.Irinotecan pharmacokinetics/pharmacodynamics and UGT1A genetic polymorphisms in Japanese:roles of UGT1A1*6 and *28[J].Pharmacogenet Genomics,2007,17(7):497-504.
[31] Yamashita K,Nagashima F,Fujita K,et al.Phase I/II study of FOLFIRI in Japanese patients with advanced colorectal cancer[J].Jpn J Clin Oncol,2011,41(2):204-209.
[32] Satoh T,Ura T,Yamada Y,et al.Genotype-directed,dose-finding study of irinotecan in cancer patients with UGT1A1*28 and/or UGT1A1*6 polymorphisms[J].Cancer Sci,2011,102(10):1868-1873.
[33] 徐建明.伊立替康联合氟尿嘧啶治疗晚期结直肠癌的疗效和毒性的预测研究[D].军事医学科学院附属医院,2009.
致谢2015年度审稿人
本刊在2015年的编辑过程中, 得到了以下审稿人的支持(按审稿数量和审稿人姓名的汉语拼音排列 ) 。特致谢意 !
崔 炜 郭艺芳 李玉坤 平 芬 宋 宁 孙武装 佟 飞 王富军 王建华 王 绵 肖文良
赵彩彦 郑华城
常英军 傅淑霞 管兴志 郭红仙 郭惠芳 郝玉明 胡振杰 姜慧卿 李星涛 李 英 李拥军
李震中 林凤茹 刘 凡 刘改芳 刘俊艳 刘 巍 田凤军 王冬梅 王维平 王战建 魏 平
夏金荣 徐金升 袁雅冬 张海松 赵建宏 甄 真
董士民 段 争 冯 珏 冯平勇 冯荣芳 冯志杰 冯志山 付向华 高 原 顾 平 郭晓楠
韩若凌 郝长来 霍丽娟 贾辛未 靳洪涛 孔 丽 李广平 李 静 李 筠 李俊侠 李 勇
刘爱京 刘 刚 刘好文 刘淑霞 陆祖谦 吕佩源 吕英谦 南月敏 倪爱华 彭应心 齐晓勇
秦照明 任金海 宋光耀 孙吉林 孙英彩 谭会斌 檀国军 田英平 汪明明 汪 昕 王 军
王立芹 王铭维 王 荣 王 文 王小玲 王晓鹏 王新良 王学义 王 毅 吴明利 武湘云
谢瑞琴 辛 虹 邢恒国 鄢盛恺 杨红申 杨冀萍 杨金国 展玉涛 张 成 张凤肖 张会丰
张金巧 张敬宇 张力辉 张 莉 张 玲 张瑞星 张松筠 张祥宏 张祥建 张晓岚 赵宗茂
(临床荟萃编辑部)
收稿日期:2015-09-23 编辑:姜恒丽
doi:10.3969/j.issn.1004-583X.2016.01.029
中图分类号: R735
文献标识码: A
文章编号: 1004-583X(2016)01-0112-05
通信作者:徐亮,Email:Lws0114@yahoo.com.cn

