·综述·
许丽丽,李莉娟,周 文,王文媛,张连生
(兰州大学第二临床医学院 兰州大学第二医院 血液科,甘肃 兰州 730030)
摘 要:髓源性抑制细胞 (myeloid-derivedsuppressorcells,MDSC)是肿瘤中重要的免疫抑制细胞,近年来,关于MDSC细胞促肿瘤机制及相关免疫治疗的研究日渐深入,本文就MDSC在肿瘤免疫治疗的研究进展做一综述。
关键词:骨髓细胞;信号通路;肿瘤;免疫疗法
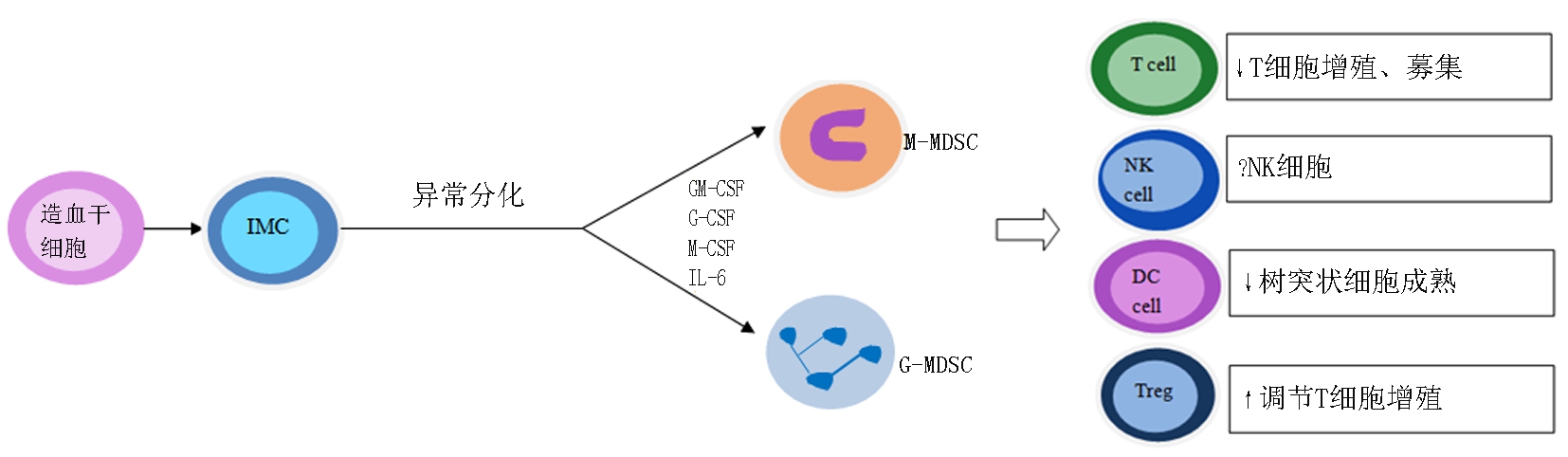
髓源性抑制细胞 (myeloid-derivedsuppressorcells,MDSC)来源于造血干细胞分化的未成熟髓系细胞(immaturemyeloidcells,IMCs),进而分化为中性粒细胞及树突状细胞和巨噬细胞。在肿瘤环境中,IMCs由于分化受阻而成为不成熟的髓系前体细胞、粒细胞单核巨噬细胞等[1],参与抗肿瘤免疫抑制,促进肿瘤细胞发生免疫逃逸。在小鼠体内缺少成熟髓系细胞表面标记的表达,MDSC被定义为表达CD11b和Gr-1抗原的细胞[2],MDSC主要分为两群(如图1),分别为粒细胞样G-MDSC(CD11b+Ly6C-Ly6G+)和单核细胞样M-MDSC(CD11b+Ly6C+Ly6G-)[4];在人体我们通常将表达抗原CD14-CD11b+的细胞定义为MDSC细胞,这些细胞表达髓系标记CD33抗原,但缺乏成熟髓系细胞表面标志和人类白细胞DR抗原(HLA-DR)。

图1MDSC细胞分化、增殖及功能:肿瘤细胞可产生包括集落刺激因子(GM-CSF)、粒细胞集落刺激因子(G-CSF)、巨噬细胞集落刺激因子(M-CSF)、白细胞介素(IL) -6在内的多种炎症介质刺激MDSC细胞的增殖和活化,进而影响免疫细胞的数量和功能变化
1.1 核因子κB(NF-κB)信号通路 大量研究发现核NF-κB信号通路与MDSC细胞的形成、招募和活性关系密切。Arora[3]和Bunt等[4]均证实TLR4参与MDSC细胞的分化、增殖及功能调节。肿瘤分泌的IL-1β通过激活NF-κB信号通路促进MDSC细胞动员和增殖,肿瘤微环境中高表达的血管内皮生长因子(VEGF)可以刺激NF-κB通路下调FLT3L表达,促进髓系祖细胞异常分化成为MDSC细胞。1.2 细胞信号激活及转录因子(STAT)家族STAT家族与MDSC细胞的募集和增殖关系密切。STAT3的磷酸化和过表达,可以上调促炎蛋白S100A8/9,抑制DC细胞和巨噬细胞的分化,从而导致MDSC的募集[5],通过上调细胞周期蛋白D1、促生长基因myc、凋亡抑制基因bcl-xl阻滞正常细胞的增殖,促进MDSC细胞的增殖。STAT1可以上调MDSC内的一氧化氮合酶(iNOS)和精氨酸酶-1(Arg-1)的表达,抑制T细胞功能[6]。STAT6也可通过上调MDSC表达AGR-1和转化生长因子(TGF)-β,从而抑制细胞抗肿瘤免疫效应。STAT3可由T细胞所分泌的γ干扰素(IFN-γ)[7]活化,而STAT1和STAT6可由IL-4和IL-13活化[8]。
1.3Ras家族Ras家族由具有GTPase活性的低分子量蛋白质组成,在人类中,Ras基因编码4种蛋白:HRas、NRas、Kras4A和Kras4B,其基因突变可促进肿瘤细胞增殖和转移。Ras信号在髓系祖细胞发展分化中发挥重要作用。在肿瘤微环境中,Ras通路的活化可促进体内多条信号途径激活导致VEGF等促癌因子上调,通过下调肿瘤细胞表面主要组织相容性复合体(MHC)限制性细胞因子,进一步造成免疫逃逸。在小鼠胰腺癌模型中[9],活化的Kras促进巨噬细胞炎症蛋白(MIP)-2和单核细胞趋化蛋白(MCP)-1的表达, 导致MDSC募集,使肿瘤逃避宿主免疫监视。
1.4TGF-β信号通路TGF-β是影响细胞增殖、凋亡和迁移的重要细胞因子,属于TGF-β超家族,其配体在T细胞、NK细胞及髓系细胞上高表达。在肿瘤微环境中,TGF-β主要来源于机体的固有免疫系统,肿瘤中高水平的TGF-β可通过调控Smad转录因子水平抑制IFN-γ的产生,同时通过降低NK细胞配体NK2GD的表达进一步降低NK细胞活性[10]。Li等[11]对肝脏肿瘤小鼠的研究表明MDSC数量和NK细胞活性成反比。未成熟髓系细胞和肿瘤来源的TGF-β密切相关,实验表明在肿瘤中MDSC细胞是TGF-β和金属蛋白酶的主要来源,帮助肿瘤细胞发生免疫逃逸[12]。
MDSC细胞抑制T细胞发挥抗肿瘤免疫作用,主要通过以下途径:①MDSC细胞高表达Arg1和iNOS,Arg1可消耗L-精氨酸(L-Arg),导致T细胞分化周期停滞。此外,MDSC还可下调T细胞上CD3ζ链[13]表达,阻滞T细胞活化;②MDSC可生产活性氧(reactiveoxygenspecies,ROS),研究发现[14]ROS可灭活T细胞受体,减少CD3ζ链表达,阻碍信号传递,抑制T细胞的活化和增殖;同时,MDSC产生活性氮(NOS),分解代谢L-Arg发挥抑制T细胞作用,NOS可进一步分解成为一氧化氮(NO)和氧自由基反应形成过氧化亚硝酸盐(Peroxynitrite,ONOO-),硝基化TCR受体、T细胞活化因子和多种氨基酸,进一步引起T细胞耗竭;③T细胞进入肿瘤淋巴结或肿瘤微环境中依赖于L-选择素。MDSC细胞表面所表达的解聚素-金属蛋白酶17(ADAM-17)可下调L-选择素的表达,介导T细胞归巢,抑制其抗肿瘤免疫效应;④有研究表明肿瘤的低氧环境可诱导缺氧诱导因子 (HIF) -1α表达上调,导致MDSC细胞高表达PD-L1,与T细胞表面的PD-1结合诱导T细胞凋亡,影响肿瘤微环境中T细胞的数量[15]。
MDSC细胞不仅可通过抑制T细胞调节抗肿瘤免疫,也可通过诱导调节性T细胞(Treg)增殖,使肿瘤微环境处于免疫抑制状态。Treg细胞为CD4+T中一员,表达CD25和FOXP3转录因子,可诱导肿瘤坏死因子受体,抑制CTL细胞活化。在肿瘤中MDSC细胞高表达CCL3、CCL4、CCL5等趋化因子,可使CCR5受体表达上调,进一步聚集Treg细胞。Schlecker等[16]也表明CCR5缺陷可使Treg细胞数量降低;在小鼠淋巴瘤实验中也发现MDSC细胞可通过高表达Arg1,诱导T细胞分化成为Treg[17]。
肿瘤中MDSC细胞的募集可造成由髓系祖细胞分化而来的成熟树突状细胞(Dentriccells,DC)比例下降,MDSC可通过产生IL-10抑制DC细胞所介导的T细胞和活化,此外,MDSC可降低DC细胞相关的DC疫苗、DC-CIK等免疫治疗的疗效。单核细胞源性巨噬细胞移动抑制因子(monocyte-derivedmacrophagemigrationinhibitoryfactor,MIF)为肿瘤相关MDSC细胞免疫抑制功能相关因子,实验通过分离晚期黑色素瘤患者外周血中MDSC细胞,给予MIF抑制剂干预后可导致免疫抑制状态的MDSC细胞转换为具有抗肿瘤免疫效应的免疫刺激型DC细胞[18]。
MDSC细胞在肿瘤微环境中对自然杀伤细胞(naturalkillercells,NKcell)的作用尚存在争议,Liu等[19]在肿瘤小鼠模型中,通过分离MDSC细胞发现其可以接触性抑制方式抑制NK细胞发挥细胞毒性作用。NKG2D是NK细胞表面的活化受体,可直接活化NK细胞,MHC-Ⅰ类链相关分子(MHCIchain-relatedmolecule,MIC)为NKG2D受体的配体,在肿瘤患者中肿瘤源性MIC可通过降低免疫细胞表面的NKG2D表达,并通过STAT3信号通路促进MDSC细胞的扩增,从而诱导抗肿瘤免疫抑制[20]。相反,Nausch等[21]发现在接种淋巴瘤小鼠模型中,MDSC细胞可以通过激活NK细胞受体和配体,进一步促使NK细胞产生IFN-γ,上调NK细胞的抗肿瘤免疫效应。
对于靶向MDSC细胞的治疗方案,其主要思路为清除或减少MDSC细胞的数量及相关细胞因子的表达。近年来的研究发现了许多针对MDSC细胞的潜在治疗靶点。
放射性治疗是癌症治疗的常规治疗方法,为了探索放射性治疗对MDSC细胞的影响,Abermathy等[22]通过建立小鼠非小细胞型肺癌模型给予放射性治疗1周后,使用流式细胞仪计数MDSC细胞并检测Arg1的表达,结果发现在CD11b+细胞中,Arg-1的表达明显降低,这表明放射性治疗可以降低MDSC细胞数,并减少MDSC细胞相关细胞因子的表达。
恩替诺特为选择性组蛋白去乙酰化酶抑制剂(histonedeacetylaseinhibitors,HDACi),大量研究表明其抗肿瘤作用与免疫调节相关。组蛋白乙酰化和脱乙酰化均可调节基因的表达,组蛋白去乙酰化酶(histonedeacetylases,HDAC)可阻止基因转录。其中HDAC11参与造血系统分化和移植物抗宿主病(Graft-versus-hostdisease,GVHD),Sahakian等[23]研究发现HDAC11可抑制MDSC细胞的扩增,并且从敲除HDAC11小鼠脾脏内分离出的MDSC细胞,其免疫抑制作用更强;HDAC2也可通过表观遗传学改变Rb1基因,使M-MDSC分化为G-MDSC[24]。Tomitaa等[25]研究发现在乳腺癌患者使用HDACi后MDSC细胞数明显减低,并且MDSC细胞表达CD40抗原也明显减低,而表达HLA-DR的CD14+单核细胞数明显升高,HDACi可作为清除MDSC细胞的免疫治疗的新靶点。
雷尼替丁和法莫替丁为常见的H2(组胺)受体拮抗剂,常用于胃肠道系统疾病中,既往研究发现其可调节如结肠癌及肺癌动物模型肿瘤生长,为研究其与MDSC细胞的关系,Vila-Leahey等[26]在乳腺癌小鼠模型中给予口服雷尼替丁和法莫替丁,检测发现小鼠的脾脏和骨髓中MDSC细胞数明显减低,但是给予H1和H4受体拮抗剂后,并未发现此种改变,除此之外,雷尼替丁可降低E0771(乳腺癌)模型肿瘤生长速度,这表明雷尼替丁治疗肿瘤可能与减少MDSC细胞数相关。
Cappello等[27]研究发现超过60%胰腺导管腺癌(pancreaticductaladenocarcinoma,PDA)患者可检测到癌症相关抗原α-烯醇化酶(α-enolase,ENO1)的表达,并且发现MDSC细胞表面也表达ENO1,并且在给予抗ENO1抗体干预MDSC细胞后,其分泌的IFN-γ和IL-17增多,IL-10和TGF-β减少,其对效应T细胞的抑制作用减弱。
基因的从头合成和DNA甲基化依赖于DNA甲基转移酶(DNAmethyltransferases,DNMTs),DNMT可与甲基化的DNA结合[28];Δ9-四氢大麻酚(Δ9-Tetrahydrocannabinol,THC)为大麻提取物,实验发现将其注入野生型小鼠体内,可引起MDSC细胞DNMT3a和DNMT3b两种酶启动子的甲基化水平提高,并可引起MDSC细胞表达Arg-1和STAT3水平减低,进一步导致MDSC免疫抑制功能减弱,这说明THC可从表观遗传学改变MDSC细胞的分化和功能[29]。
miRNA是真核生物中广泛存在的一类长约21~23个核苷酸的RNA,通过与目标mRNA结合,进而抑制转录后的基因表达, 在调控基因表达、细胞周期等方面起重要作用。研究表明miRNA可通过其本身反转录作用调节MDSC细胞的扩增、分化、迁移和功能。MiR-210可上调MDSC细胞对Arg-1、IL-1和CXCL12的表达水平[30];miR-9可抑制MDSC细胞分化,但可促进MDSC细胞的免疫抑制功能[31]。
此外,BMP4为TGFβ生长因子家族成员,可通过抑制NF-κB信号通路,从而减少G-CSF的表达[32];L-单甲基精氨酸(NG-monomethyl-L-arginineacetate,L-NMMA)为NOS抑制剂,可靶向针对小鼠MDSC细胞表面的iNOS,治疗MDSC细胞相关的溶骨性肿瘤疾病[33];舒尼替尼可提高效应性T细胞数,耗尽肿瘤微环境中MDSC细胞,从而增强机体抗肿瘤免疫反应[34]。
除上述国外实验研究针对MDSC肿瘤免疫治疗,我国针对MDSC细胞研究也有突破。由于粒细胞集落刺激因子(G-CSF) 的聚集可导致MDSC细胞的增殖,进而募集MDSC细胞抑制固有免疫应答[35],Wei等[36]通过建立人乳腺癌小鼠模型,发现成瘤模型中G-CSF的活性和G-MDSC细胞数量均高表达,鬼针草(B.pilosa,BP-E)提取物聚乙炔苷(polyacetylenicglycosides,BP-E-F1)可抑制G-CSF诱导的G-MDSC细胞分化,可能成为靶向MDSC细胞的临床新药。
MDSC细胞在健康人中表达极低,但在肿瘤状态下,IMCs分化受阻,MDSC细胞表达量明显升高,其产生与调节机制研究日渐深入,本文就STAT、NF-κB等调节MDSC细胞水平相关信号通路、MDSC相关肿瘤免疫、MDSC相关表观遗传学异常及MDSC细胞的肿瘤治疗研究现状进行详细阐述,对进一步探索MDSC细胞的免疫机制及针对MDSC细胞的靶向治疗提供理论依据,相信通过MDSC肿瘤免疫的深入研究,可为临床MDSC靶向治疗肿瘤提供新思路、新方法。
参考文献:
[1]MarvelD,GabrilovichDI.Myeloid-derivedsuppressorcellsinthetumormicroenvironment:expecttheunexpected[J].JClinInvest, 2015, 125(9):3356-3364.
[2]SuZ,NiP,ZhouC,etal.Myeloid-DerivedSuppressorCellsinCancersandInflammatoryDiseases:AngelorDemon?[J].ScandJImmunol, 2016, 84(5):255-261.
[3]AroraM,PoeSL,OrissTB,etal.TLR4/MyD88-inducedCD11b+Gr-1intF4/80+non-migratorymyeloidcellssuppressTh2effectorfunctioninthelung[J].MucosalImmunol, 2010, 3(6):578-593.
[4]BuntSK,ClementsVK,HansonEM,etal.Inflammationenhancesmyeloid-derivedsuppressorcellcross-talkbysignalingthroughToll-likereceptor4[J].JLeukocBiol, 2009, 85(6):996-1004.
[5]ChengP,CorzoCA,LuettekeN,etal.Inhibitionofdendriticcelldifferentiationandaccumulationofmyeloid-derivedsuppressorcellsincancerisregulatedbyS100A9protein[J].JExpMed, 2008, 205(10):2235-2249.
[6]MovahediK,GuilliamsM,VandenBosscheJ,etal.Identificationofdiscretetumor-inducedmyeloid-derivedsuppressorcellsubpopulationswithdistinctTcell-suppressiveactivity[J].Blood, 2008, 111(8):4233-4244.
[7] 李莉娟,张连生.细胞免疫治疗现状与前景[J].临床血液学杂志,2015,28(5):370-373,379.
[8]MessmannJJ,ReisserT,LeithauserF,etal.Invitro-generatedMDSCspreventmurineGVHDbyinducingtype2Tcellswithoutdisablingantitumorcytotoxicity[J].Blood, 2015,126(9):1138-1148.
[9]ClarkCE,HingoraniSR,MickR,etal.Dynamicsoftheimmunereactiontopancreaticcancerfrominceptiontoinvasion[J].CancerRes, 2007, 67(19):9518-9127.
[10]LeeJC,LeeKM,KimDW,etal.ElevatedTGF-beta1secretionanddown-modulationofNKG2DunderliesimpairedNKcytotoxicityincancerpatients[J].JImmunol, 2004, 172(12):7335-7340.
[11]LiH,HanY,GuoQ,etal.Cancer-expandedmyeloid-derivedsuppressorcellsinduceanergyofNKcellsthroughmembrane-boundTGF-beta1[J].JImmunol, 2009, 182(1):240-249.
[12]YangL,HuangJ,RenX,etal.AbrogationofTGFbetasignalinginmammarycarcinomasrecruitsGr-1+CD11b+myeloidcellsthatpromotemetastasis[J].CancerCell, 2008, 13(1):23-35.
[13]RodriguezPC,QuicenoDG,ZabaletaJ,etal.ArginaseIproductioninthetumormicroenvironmentbymaturemyeloidcellsinhibitsT-cellreceptorexpressionandantigen-specificT-cellresponses[J].CancerRes, 2004, 64(16):5839-5849.
[14]KusmartsevS,NefedovaY,YoderD,etal.Antigen-specificinhibitionofCD8+Tcellresponsebyimmaturemyeloidcellsincancerismediatedbyreactiveoxygenspecies[J].JImmunol, 2004, 172(2):989-999.
[15]NomanMZ,DesantisG,JanjiB,etal.PD-L1isanoveldirecttargetofHIF-1alpha,anditsblockadeunderhypoxiaenhancedMDSC-mediatedTcellactivation[J].JExpMed, 2014, 211(5):781-790.
[16]SchleckerE,StojanovicA,EisenC,etal.Tumor-infiltratingmonocyticmyeloid-derivedsuppressorcellsmediateCCR5-dependentrecruitmentofregulatoryTcellsfavoringtumorgrowth[J].JImmunol, 2012, 189(12):5602-5611.
[17]SerafiniP,MgebroffS,NoonanK,etal.Myeloid-derivedsuppressorcellspromotecross-toleranceinB-celllymphomabyexpandingregulatoryTcells[J].CancerRes, 2008,68(13):5439-5449.
[18]YaddanapudiK,RendonBE,LamontG,etal.MIFisnecessaryforlate-stagemelanomapatientMDSCimmunesuppressionanddifferentiation[J].CancerImmunolRes, 2016, 4(2):101-112.
[19]LiuC,YuS,KappesJ,etal.ExpansionofspleenmyeloidsuppressorcellsrepressesNKcellcytotoxicityintumor-bearinghost[J].Blood, 2007, 109(10):4336-4342.
[20]XiaoG,WangX,ShengJ,etal.SolubleNKG2DligandpromotesMDSCexpansionandskewsmacrophagetothealternativelyactivatedphenotype[J].JHematolOncol, 2015, 8:13.
[21]NauschN,GalaniIE,SchleckerE,etal.Mononuclearmyeloid-derived“suppressor”cellsexpressRAE-1andactivatenaturalkillercells[J].Blood, 2008, 112(10):4080-4089.
[22]AbernathyLM,FountainMD,JoinerMC,etal.Innateimmunepathwaysassociatedwithlungradioprotectionbysoyisoflavones[J].FrontOncol, 2017, 7:7.
[23]SahakianE,PowersJJ,ChenJ,etal.Histonedeacetylase11:Anovelepigeneticregulatorofmyeloidderivedsuppressorcellexpansionandfunction[J].MolImmunol, 2015, 63(2):579-585.
[24]ZhangC,WangS,LiuY,etal.Epigeneticsinmyeloidderivedsuppressorcells:asheathedswordtowardscancer[J].Oncotarget, 2016, 7(35):57452-57463.
[25]TomitaY,LeeMJ,LeeS,etal.Theinterplayofepigenetictherapyandimmunityinlocallyrecurrentormetastaticestrogenreceptor-positivebreastcancer:CorrelativeanalysisofENCORE301,arandomized,placebo-controlledphaseⅡtrialofexemestanewithorwithoutentinostat[J].Oncoimmunology, 2016, 5(11):e1219008.
[26]Vila-LeaheyA,OldfordSA,MarignaniPA,etal.Ranitidinemodifiesmyeloidcellpopulationsandinhibitsbreasttumordevelopmentandspreadinmice[J].Oncoimmunology, 2016, 5(7):e1151591.
[27]CappelloP,TonoliE,CurtoR,etal.Anti-alpha-enolaseantibodylimitstheinvasionofmyeloid-derivedsuppressorcellsandattenuatestheirrestrainingeffectorTcellresponse[J].Oncoimmunology, 2016, 5(5):e1112940.
[28]JacksonAR,HegdeVL,NagarkattiPS,etal.Characterizationofendocannabinoid-mediatedinductionofmyeloid-derivedsuppressorcellsinvolvingmastcellsandMCP-1[J].JLeukocBiol, 2014, 95(4):609-619.
[29]SidoJM,YangX,NagarkattiPS,etal.Delta9-Tetrahydrocannabinol-mediatedepigeneticmodificationselicitmyeloid-derivedsuppressorcellactivationviaSTAT3/S100A8[J].JLeukocBiol, 2015, 97(4):677-688.
[30]NomanMZ,JanjiB,HuS,etal.Tumor-promotingeffectsofmyeloid-derivedsuppressorcellsarepotentiatedbyhypoxia-inducedexpressionofmiR-210[J].CancerRes, 2015,75(18):3771-3787.
[31]TianJ,RuiK,TangX,etal.MicroRNA-9regulatesthedifferentiationandfunctionofmyeloid-derivedsuppressorcellsviatargetingrunx1[J].JImmunol, 2015, 195(3):1301-1311.
[32]CaoY,SlaneyCY,BidwellBN,etal.BMP4inhibitsbreastcancermetastasisbyblockingmyeloid-derivedsuppressorcellactivity[J].CancerRes, 2014, 74(18):5091-5102.
[33]SawantA,PonnazhaganS.Myeloid-derivedsuppressorcellsasanoveltargetforthecontrolofosteolyticbonedisease[J].Oncoimmunology, 2013, 2(5):e24064.
[34]DraghiciuO,NijmanHW,HoogeboomBN,etal.Sunitinibdepletesmyeloid-derivedsuppressorcellsandsynergizeswithacancervaccinetoenhanceantigen-specificimmuneresponsesandtumoreradication[J].Oncoimmunology, 2015, 4(3):e989764.
[35]YounisRH,HanKL,WebbTJ.Humanheadandnecksquamouscellcarcinoma-associatedsemaphorin4Dinducesexpansionofmyeloid-derivedsuppressorcells[J].JImmunol, 2016, 196(3):1419-1429.
[36]WeiWC,LinSY,LanCW,etal.InhibitingMDSCdifferentiationfrombonemarrowwithphytochemicalpolyacetylenesdrasticallyimpairstumormetastasis[J].SciRep, 2016,6:36663.
通信作者:张连生,Email:zhangliangsheng@medmail.com.cn
中图分类号:R
文献标志码:A
文章编号:1004-583X(2017)06-0545-04
doi:10.3969/j.issn.1004-583X.2017.06.023
收稿日期:2017-02-22 编辑:张卫国